| 1 原理 钛离子在PH=2时,和EDTA生成稳定的络合物,但其极易水解,故不宜直接滴定。加H2O2并使其和钛离子作用生成Ti(H2O2),氧钛基不易水解,且仍能和过量的EDTA生成1:1的络合物。在PH=1.1―1.5的酸度下,以二甲酚橙为指示剂,用硝酸铋回滴过剩的EDTA。 在PH=1.6―2.0的微酸性溶液中,Fe3+与磺基水杨酸钠(Sal2-代表磺基水扬酸钠阴离子)生成紫红色络合物。由于Fe3+与EDTA的络合物FeY-比FeSaI-稳定,所以当滴入EDTA后,FeSal+中的Fe3+被EDTA夺取。FeY-为无色或浅黄色。 2 测定方法 称样0.2500g于预先加有1gK2S2O7的瓷坩埚中,加2gK2S2O7,盖上坩埚盖并放入马弗炉中,开启电炉,升温至650℃--700℃,持续15min后取出坩埚,应即揭盖,冷至室温,水洗坩埚和坩埚盖外壁,转入已盛有50mlH2SO4(5%)的烧杯中,浸出熔块,洗出坩埚和坩埚盖,微沸至熔块全部溶解和溶液清澈,冷至室温,转入250ml容量瓶中,用H2SO4(5%)定容,摇匀。 取待测溶液25ml于300ml锥形瓶中,加入H2O2(30%)2―3ml后。加入EDTA标准液(0.0025mol・L-1)20.00ml,加溴酚蓝(1%乙醇液)2滴,用氨水(1+1)调节至试液呈亮黄色,加H2SO4(0.5mol・L-1)8ml,二甲酚橙(0.1%水溶液)2滴,然后用Bi(NO3)3,标准溶液(0.01mol・L-1)滴定,溶液由黄色变为橙色即为终点,得Fe2O3、TiO2总量。 再取待测液25ml于300ml锥形瓶中,加苦杏仁酸5ml(10%),以掩蔽Ti4+,加入10―12滴10%磺基水扬酸钠指示剂,用水稀释至150ml,以氨水(1+1)调节试液PH值于1.5―18。加热至60―70℃,用0.025mol EDTA标准溶液滴定至溶液由紫色变为无色即为终点,得Fe2O3含量: 3 计算 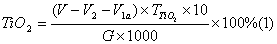 式中:V――加入EDTA标准溶液的毫升数; V1――滴定时消耗硝酸铋标准溶液的毫升数; V2――测定FeO时,消耗EDTA标准溶液的亳升数; a――硝酸铋标准溶液对EDTA标准溶液的体积比; 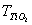 ――EDTA标准溶液对氧化钛的滴定度(毫克/毫升); ――EDTA标准溶液对氧化钛的滴定度(毫克/毫升); G――试样重量(克)。 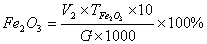 (2) (2) 式中:V2――滴定时消耗EDTA标准溶液的毫升数; 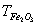 ――EDTA标准溶液对氧化铁的滴定度(毫克/毫升); ――EDTA标准溶液对氧化铁的滴定度(毫克/毫升); G――试样重量(克)。 4 讨论 测定TiO2、Fe2O3总量时,应用硝酸和硫酸调节溶液的酸度,而不宜用盐酸,因此能与硝酸铋标准滴定溶液生成氯氧化铋(BiOCI)沉淀,而干扰测定。 将溶液冷却至20℃以下,再加EDTA可防止铝的干扰。 用EDTA滴定Fe3+时,溶液的PH值应控制在1.6―1.8,否则结果会有偏差。 由于EDTA与Fe3+络合速度慢,滴定速度不宜太快,并要不断搅拌,否则将使测定结果偏高。下表为标准值与测定值的比较。 样品标准值与测定值结果对照表(%) 样品 | 标准值 | 测定值 | TiO2 | Fe2O3 | TiO2 | Fe2O3 | 钛黄粉1# | 94.18 | 1.51 | 94.25 | 1.14 | 钛黄粉2# | 89.20 | 2.07 | 89.37 | 2.18 | 金红石1# | 88.95 | 2.55 | 88.80 | 2.43 | 金红石2# | 87.62 | 2.82 | 87.71 | 2.74 |
|

